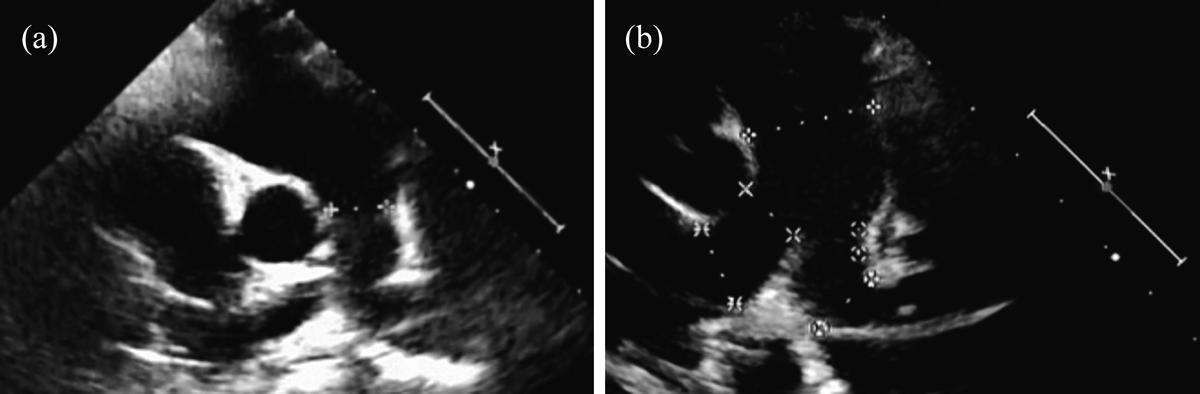
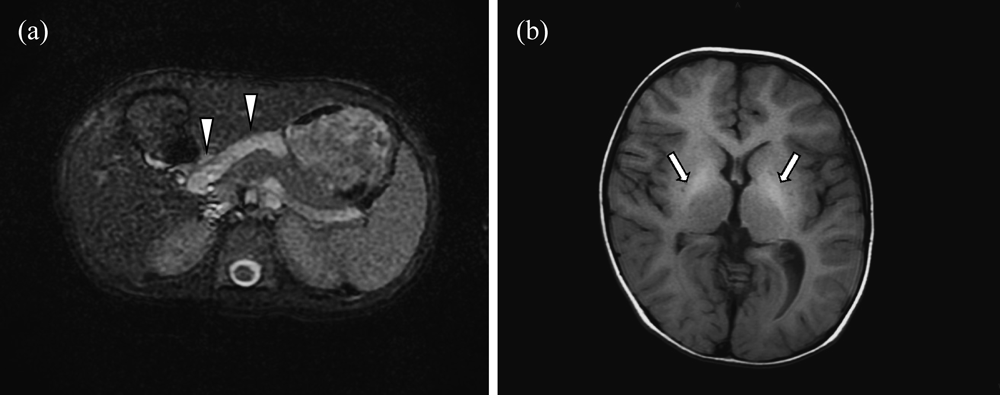
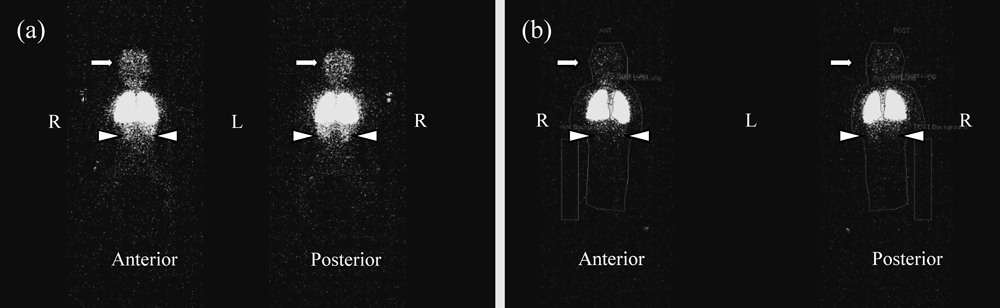
門脈体循環シャントによる肺高血圧症及び肺内シャントを合併したNoonan症候群の1例A Case of Pulmonary Hypertension and Intrapulmonary Shunt Caused by Porto-Pulmonary Shunt with Noonan Syndrome
1 岡崎市民病院小児科Department of Pediatrics, Okazaki City Hospital ◇ 〒444-8553 愛知県岡崎市高隆寺町字五所合3番地13-1 Koryuji-cho Goshoai, Okazaki-shi, Aichi 444-8553, Japan
2 名古屋大学医学部小児科学教室Laboratory of Pediatrics, School of Medicine, Nagoya University ◇ 〒466-8550 愛知県名古屋市昭和区鶴舞町65番地65 Tsurumai-cho, Showa-ku, Nagoya-shi, Aichi 466-8550, Japan
3 名古屋大学医学部小児外科学教室Laboratory of Pediatric Surgery, School of Medicine, Nagoya University ◇ 〒466-8550 愛知県名古屋市昭和区鶴舞町65番地65 Tsurumai-cho, Showa-ku, Nagoya-shi, Aichi 466-8550, Japan
4 名古屋大学医学部附属病院救急・内科系集中治療部Emergency and Medical Intensive Care Unit, Nagoya University Hospital ◇ 〒466-8560 愛知県名古屋市昭和区鶴舞町65番地65 Tsurumai-cho, Showa-ku, Nagoya-shi, Aichi 466-8560, Japan