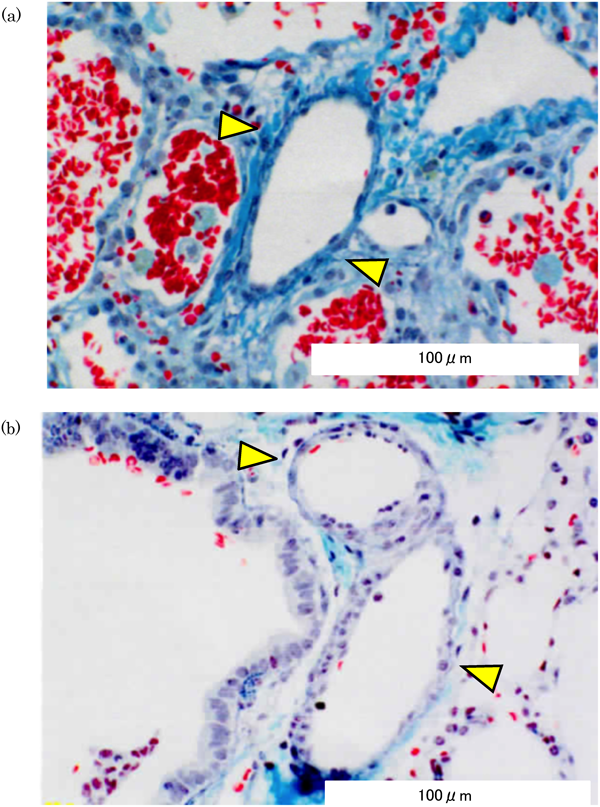
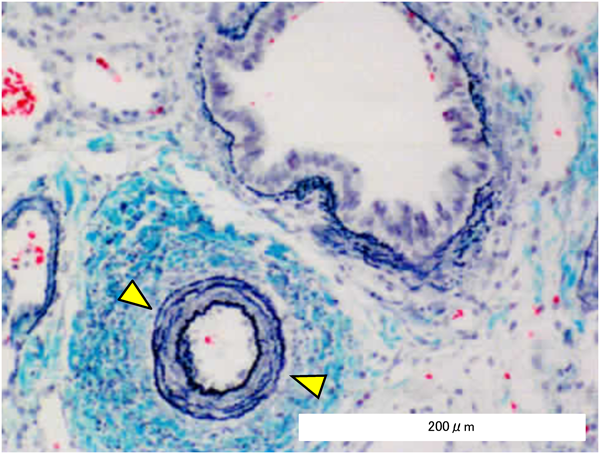
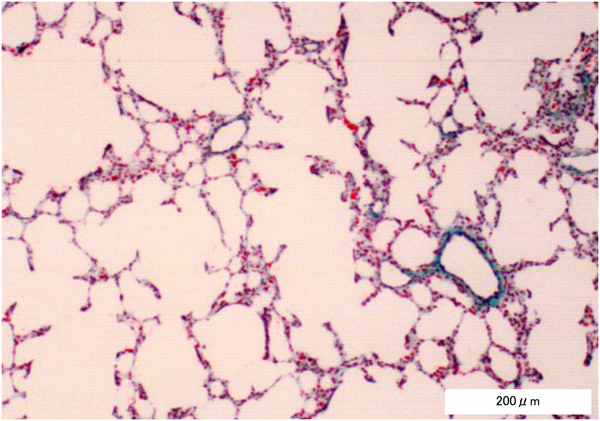
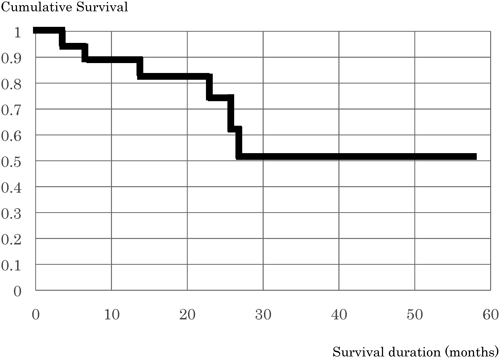
肺生検組織所見,臨床経過から考える18トリソミーの管理Management of Trisomy 18 Based on the Clinicopathology of Pulmonary Arteriopathy and Clinical Course
1 土谷総合病院小児科Department of Pediatrics, Tsuchiya General Hospital ◇ 〒730-8655 広島市中区中島町3番30号3-30 Nakajima-cho, Naka-ku, Hiroshima-shi, Hiroshima 730-8655, Japan
2 土谷総合病院心臓血管外科Department of Cardiovascular Surgery, Tsuchiya General Hospital ◇ 〒730-8655 広島市中区中島町3番30号3-30 Nakajima-cho, Naka-ku, Hiroshima-shi, Hiroshima 730-8655, Japan